StressMarq Biosciences
Alle StressMarq Biosciences Produkte anzeigen
StressMarq ist führend in der Entwicklung und Kommerzialisierung einer Reihe einzigartiger fibrilisierter und oligomerer Proteinpräparationen für die Forschung zu neurodegenerativen Erkrankungen, einschließlich Proteinen wie Alpha-Synuclein, Tau, Amyloid-beta, SOD1 und TTR. Die strategischen Bemühungen von StressMarq konzentrieren sich darauf, das Angebot an Produkten zu erweitern und zu vertiefen, um Forschern zu helfen, die Alzheimer, Parkinson und andere neurodegenerative Krankheiten untersuchen.
In den kommenden Jahren wird StressMarq die Lebenswissenschaftsforschung weiterhin mit dem Leitsatz. Discovery through partnership, and Excellence through quality“ unterstützen.
Neben unserem Fokus auf Produkte für die Forschung zu neurodegenerativen Erkrankungen wird unser vielfältiges Portfolio an Antikörpern, Proteinen, Kits und kleinen Molekülen in verschiedenen Bereichen der Lebenswissenschaften eingesetzt, einschließlich Neurowissenschaften, Krebsforschung und Zell-Signaltransduktion.
Um die weltweite Forschung zu unterstützen, sind StressMarq-Produkte über ein umfassendes Netzwerk internationaler Distributoren in mehr als 45 Ländern erhältlich.
StressMarq KundenspezifischeFormulare
StressMarq Vorgestellte Produkte
Neue aktive Synuclein-Protein-Fibrillen und Monomere
"Wir haben aktive Alpha-Synuclein-Protein-Fibrillen entwickelt, die verwendet werden können, um endogene Alpha-Synuclein-Phosphorylierung und die anschließende Bildung von Lewy-Körper-Inklusionen in neuronalen Zellkulturen oder für in-vitro-Oligomerisierungsstudien zu induzieren.
Unsere aktiven Alpha-Synuclein-Protein-Fibrillen fördern die Bildung neuer Fibrillen aus aktiven Alpha-Synuclein-Monomeren.
Typ-1-Human- und Maus-Preformed Fibrils (PFFs) und Monomere wurden in Zellkultur-Assays und Thioflavin-T-Tests getestet. Human- und Maus-PFFs wurden in vivo getestet und führten innerhalb von 30 Tagen nach Injektion zu Alpha-Synuclein-Pathologie im Gehirn von Ratten. A53T Alpha-Synuclein-Monomere und PFFs sind ebenfalls erhältlich. Die A53T-Mutation ist mit dem frühzeitigen Beginn der Parkinson-Krankheit und einer erhöhten Alpha-Synuclein-Fibrillisierung verbunden."
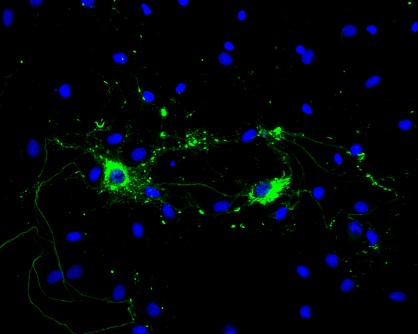
Rat-Hippocampus-Neuronen, die mit Typ-1-Maus-Alpha-Synuclein-PFFs behandelt wurden, zeigen Lewy-Körper-Inklusionen.
 IHC-Analyse von Rattengehirnen, die mit Typ-1-Maus-Alpha-Synuclein-PFFs (SPR-324) injiziert wurden, zeigt Alpha-Synuclein-Pathologie.
IHC-Analyse von Rattengehirnen, die mit Typ-1-Maus-Alpha-Synuclein-PFFs (SPR-324) injiziert wurden, zeigt Alpha-Synuclein-Pathologie.
Alpha-Synuclein-Oligomere werden zunehmend als toxische Spezies in Synucleinopathien angesehen. Dopamin und EGCG können verwendet werden, um Alpha-Synuclein in seinen oligomeren Formen zu stabilisieren und eine weitere Aggregation zu Fibrillen zu verhindern.
StressMarq's Active Tau Pre-Formed Fibrils (PFFs)
StressMarq is excited to offer active tau proteins to help researchers study tau aggregation, a hallmark of neurodegenerative diseases including Alzheimer’s. StressMarq is the first to offer active tau preformed fibrils (PFFs) and filaments for neuroscience research. The process of tau aggregation can be seeded by active tau PFFs, which recruit monomers to form larger tau fibrils. This has been demonstrated in thioflavin T assays where an increase in fluorescence, indicative of tau fibrillization, is seen when active tau PFFs are combined with active tau monomers. Certain tau PFFs have been injected into P301L mice, where they seed tau aggregation and induce tau pathology in the hippocampus.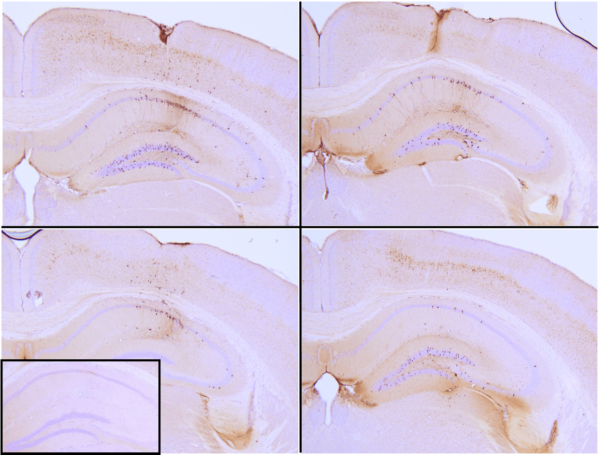
Immunohistochemistry analysis of P301L mouse hippocampus injected with K18 P301L tau PFFs (SPR-330) shows seeding of tau pathology at injection site nine weeks post-injection. AT8 (pSer202/pThr205) tau antibody shows tangle-like inclusions. Inset: negative control. Experiments performed at reMYD N.V.
Monomers and fibrils are available both in the full-length isoform of the tau protein (2N4R or Tau-441) or a truncated form (K18). Tau-441 has a molecular weight of approximately 46 kDa, whereas K18 tau has a molecular weight of approximately 15 kDa. dGAE is a fragment of the tau protein consisting of amino acids 297-391. It is one of the core PHF subunits,1 includes both microtubule-binding domains and proline-rich regions, and assembles into PHF-like fibrils in vitro without additives or templates.
Proteins are available as wild-type or with a variety of mutations. P301S and P301L mutations occur in exon 10 and are associated with frontotemporal dementia. The P301S mutation reduces tau’s ability to assemble microtubules, and the P301L mutation promotes beta-sheet formation and the formation of PHFs. Both P301S and P301L mutant transgenic mouse models are used in tau research. The K280 deletion mutation is also associated with frontotemporal dementia and promotes fibrillization into paired helical filaments (PHFs) in the absence of heparin and other inducers. The C322A mutation also increases tau’s ability to form PHFs.2
PFFs induce tau aggregation; full-length PFFs may be more effective in seeding fibrillization, but a combination of both can be particularly toxic to neurons. Most tau varieties are fibrillized using a heparin scaffold; soluble tau filaments are fibrillized using a linear anionic scaffold. dGAE tau and K18 K280 deletion tau both fibrillize without scaffolds.
Tau PFFs can be expressed in baculovirus in addition to E. coli. Baculovirus tau PFFs are post-translationally modified, fibrillize without a scaffold, and are endotoxin-free*.

-in-SK-N-BE-cells.png?width=50)

